Historia powstania sztucznego serca Religa Heart oraz systemu HeartMate
Na początek zapraszam do odkrycia fascynującej historii polskiego sztucznego serca oraz systemów wspomagających jego pracę. Poznamy, jak powstały te innowacyjne rozwiązania, które zmieniają oblicze medycyny, a także przyjrzymy się bliżej jednemu z najpopularniejszych urządzeń LVAD na świecie – HeartMate. Jako material dodatkowy szczególnie polecam aplikację mobilną LVAD stworzoną przez producenta HeartMate, która w przystępny sposób pokazuje, jak działa to zaawansowane urządzenie.
Wprowadzenie
Sztuczne serca i mechaniczne systemy wspomagania krążenia stały się przełomowym rozwiązaniem w leczeniu skrajnej niewydolności serca. Poniższy raport przedstawia historię powstania dwóch kluczowych systemów: polskiego sztucznego serca Religa Heart oraz amerykańskiego systemu HeartMate. Omówiony zostanie kontekst medyczno-technologiczny, w jakim opracowywano te urządzenia w Polsce i USA, wkład profesora Zbigniewa Religi w rozwój rodziny urządzeń Religa Heart, etapy rozwoju i partnerów obu projektów, ich zastosowania kliniczne (m.in. jako pomost do przeszczepu czy terapia docelowa), a także porównanie obu systemów pod względem technologii, rozmiarów, skuteczności, dostępności i kosztów. Informacje poparte są wiarygodnymi źródłami (literatura medyczna, publikacje naukowe oraz oficjalne komunikaty) dla zapewnienia rzetelności przedstawionych danych.
Kontekst medyczno-technologiczny rozwoju sztucznych serc
Sytuacja w Polsce – zapotrzebowanie na sztuczne serce (Religa Heart)
W drugiej połowie lat 80. w Polsce dokonał się ogromny postęp w kardiochirurgii – prof. Zbigniew Religa w 1985 r. przeprowadził pierwszą udaną transplantację serca w kraju, co zwróciło uwagę na problem braku wystarczającej liczby dawcówdzieje.pl. Sukcesy transplantologii ujawniły pilną potrzebę tymczasowego wspomagania krążenia u pacjentów oczekujących na przeszczep. Jeszcze w latach 80. Polska dysponowała skromną infrastrukturą – np. brakowało nowoczesnych aparatów do krążenia pozaustrojowegodzieje.pl – co motywowało lekarzy do poszukiwania nowych technologii ratujących życie. Prof. Religa już w 1986 r. zaczął myśleć o skonstruowaniu polskiego sztucznego serca, niedługo po dokonaniu pierwszego przeszczepunaukawpolsce.pl.
Krytycznym problemem była rosnąca liczba chorych ze schyłkową niewydolnością serca, szacowana w Polsce na około 1 mln osób pod koniec XX wiekunaukawpolsce.pl. Wielu z nich nie doczekiwało dawcy serca. Sztuczne serce mogło stać się dla tych pacjentów „pomostem” – urządzeniem podtrzymującym życie do czasu przeszczepu. Już pod koniec lat 80. pojmowano także, że mechaniczne odciążenie serca może w pewnych przypadkach prowadzić do regeneracji mięśnia sercowego (tzw. pomost do wyzdrowienia)takdlatransplantacji.pl. W Polsce przełomowym wydarzeniem było podłączenie po raz pierwszy sztucznego serca do pacjenta oczekującego na dawcę w 1991 r. przez prof. Religę, co zakończyło się pełnym powodzeniem dzieje.pl. To pionierskie osiągnięcie dowiodło, że także w polskich warunkach można zastosować mechaniczne wspomaganie krążenia u pacjenta w stanie krytycznym.
Sytuacja w USA – rozwój urządzeń LVAD (HeartMate)
W Stanach Zjednoczonych prace nad mechanicznym wspomaganiem serca rozpoczęto już w latach 60. XX w. Kontekst medyczny był podobny: dynamiczny rozwój transplantacji serca od 1967 r. (pierwszy przeszczep wykonany przez Ch. Barnarda) szybko unaocznił niewystarczającą liczbę serc do przeszczepów wobec rosnącej liczby chorychmy.clevelandclinic.orgmy.clevelandclinic.org. Już w 1966 r. dr Michael DeBakey zastosował prototypowy system wspomagania lewej komory (LVAD) jako wsparcie po operacji na sercu – pompa pracowała przez 10 dni i uratowała pacjentkęen.wikipedia.org. Jednak przez kolejne dekady większy nacisk kładziono na konstrukcję całkowitego sztucznego serca (TAH), co postępowało powoli, podczas gdy tysiące pacjentów umierały na listach oczekującychheart.org.
Na początku lat 80. nastąpiła zmiana strategii: amerykański Narodowy Instytut Serca, Płuc i Krwi (NHLBI) zdecydował się zintensyfikować badania nad długotrwałymi pompami wspomagającymi krążenie, które mogłyby utrzymywać pacjenta przy życiu przez tygodnie lub miesiąceheart.org. Efektem tych inwestycji było powstanie pierwszych trwałych systemów LVAD. Już w 1988 r. osiągnięto przełom – zespół dr. Williama Bernharda (Boston) we współpracy z firmą Thermedics stworzył prototyp urządzenia wspomagającego, które zapewniło długoterminowe krążenie u pacjenta. Projekt ten, finansowany kontraktem NIH, dał początek systemowi nazwanemu później HeartMateen.wikipedia.org.
Na początku lat 90. technologia dojrzała na tyle, że w 1994 r. FDA (Agencja Żywności i Leków USA) zatwierdziła pierwsze urządzenie LVAD jako pomost do transplantacjien.wikipedia.org. Była to pneumatyczna (napędzana powietrzem) pompa wszczepialna – HeartMate IP – wymagająca połączenia z dużą konsolą zewnętrznąheart.org. Już rok później (1995) zatwierdzono ulepszoną, elektrycznie zasilaną wersję HeartMate, znacznie bardziej przenośnąheart.org. Obie wersje określa się dziś zbiorczo jako HeartMate I (HeartMate XVE) i były one pierwszą generacją pulsacyjnych systemów wspomagania lewej komory serca w USAheart.org. W drugiej połowie lat 90. kilka ośrodków kardiochirurgicznych (m.in. dr O. H. Frazier z Texas Heart Institute) zaczęło z powodzeniem wszczepiać te urządzenia, demonstrując, że pacjenci z LVAD mogą żyć poza szpitalem, co przyciągnęło uwagę mediów i środowiska medycznegoen.wikipedia.org. To przygotowało grunt pod kolejne przełomy technologiczne w nowym tysiącleciu.
Wkład prof. Zbigniewa Religi w rozwój Religa Heart
Prof. Zbigniew Religa (1938–2009) odegrał kluczową rolę w powstaniu polskiego sztucznego serca – zarówno jako wybitny kardiochirurg, jak i wizjoner oraz organizator przedsięwzięcia. Jego dokonania medyczne stworzyły fundament pod rozwój technologii wspomagania krążenia w Polsce:
- Pionier transplantacji serca: 5 listopada 1985 r. Religa dokonał pierwszego udanego przeszczepu serca w Polsce, otwierając nową erę w krajowej kardiochirurgiidzieje.pl. Doświadczenie to uświadomiło mu skalę problemu niewydolności serca i braków w dostępności dawców. Już rok później (1986) zaczął poważnie rozważać stworzenie sztucznego serca jako rozwiązania dla pacjentów, którzy nie mogą natychmiast otrzymać organunaukawpolsce.pl.
- Pierwsze sztuczne serce w Polsce: W 1991 r. Religa dokonał przełomowej operacji – po raz pierwszy w Polsce zastosował u pacjenta sztuczne serce jako pomost do transplantacji, ratując mu życiedzieje.pl. Operacja ta polegała na wszczepieniu protezy serca choremu oczekującemu na dawcę i zakończyła się pełnym sukcesem. Było to ogromne osiągnięcie, biorąc pod uwagę ograniczone zaplecze techniczne kraju w tamtym okresie.
- Fundacja Rozwoju Kardiochirurgii (FRK): Dostrzegając konieczność rozwoju rodzimej myśli technicznej, prof. Religa założył w 1991 r. (formalnie zarejestrowana w 1992 r.) Fundację Rozwoju Kardiochirurgii im. prof. Z. Religi w Zabrzunaukawpolsce.pl. Celem Fundacji stało się stworzenie polskiego sztucznego serca. Religa skupił wokół siebie interdyscyplinarny zespół lekarzy, inżynierów i naukowców. FRK finansowała początkowe badania m.in. dzięki wsparciu społecznemu – organizując koncerty charytatywne z udziałem gwiazddzieje.pl.
- Pierwsze polskie protezy serca (POLVAD): W połowie lat 90. zespół FRK opracował prototyp polskiej protezy wspomagania serca. W 1995 r. prof. Religa po raz pierwszy wszczepił pacjentowi opracowane w Fundacji polskie sztuczne komory sercatakdlatransplantacji.pl. Były to pulsacyjne protezy typu POLVAD (Polish Ventricular Assist Device). Operacja ta zapoczątkowała fazę klinicznych zastosowań rodzimych urządzeń. Jak wspominał Religa, od 1995 r. do końca pierwszej dekady XXI w. polskie sztuczne komory zastosowano ponad 200 razy w kraju oraz kilkukrotnie za granicą (m.in. w Argentynie)takdlatransplantacji.pl. Dzięki tym zabiegom potwierdzono również obserwacje światowe, że czasowe odciążenie serca za pomocą pomp może prowadzić do poprawy lub nawet pełnej regeneracji serca w pewnych schorzeniach (np. ciężkie zapalenie mięśnia sercowego) – pacjenci powracali do zdrowia z własnym, sprawnie działającym sercem bez potrzeby transplantacjitakdlatransplantacji.pl.
- Działalność naukowa i szkoleniowa: Prof. Religa wychował całe pokolenie polskich kardiochirurgów i kardiologów. Był mentorem takich specjalistów jak prof. Marian Zembala czy dr Andrzej Bochenek. Jako nauczyciel akademicki i rektor (Śląska Akademia Medyczna) kładł nacisk na łączenie wiedzy klinicznej z badaniami naukowymi nad nowymi technologiamidzieje.pldzieje.pl. Jego autorytet naukowy (tytuł profesora uzyskał w 1995 r.) dodawał wiarygodności projektowi sztucznego serca.
- Inicjatywa rządowego programu „Polskie Sztuczne Serce”: Ważną rolę Religa odegrał również jako organizator finansowania. W latach 2005–2007 pełnił funkcję Ministra Zdrowia i wykorzystał swoją pozycję, aby zapewnić środki na rozwój sztucznego serca. Z jego inicjatywy rząd premiera Jarosława Kaczyńskiego ustanowił wieloletni program strategiczny „Polskie Sztuczne Serce” (2007–2011)takdlatransplantacji.pl. Religa osobiście przekonał premiera do znaczenia tych badań dla kraju i uzyskano finansowanie na 5-letni projekt badawczytakdlatransplantacji.pl. Program ten, koordynowany przez FRK, znacząco przyspieszył prace nad nową generacją protez serca.
- Dziedzictwo i kontynuacja prac: Choć prof. Religa zmarł w 2009 r., jego dzieło jest kontynuowane. Fundacja, która nosi jego imię, prowadzi prace badawczo-rozwojowe nieprzerwanie, a pierwszy implant z rodziny Religa Heart został dokonany przez jego syna – dr. Grzegorza Religę – w 2013 r.dzieje.pl. To symboliczne osiągnięcie domknęło wizję prof. Religi sprzed lat.
Wkład prof. Religi można podsumować krótko: był twórcą idei polskiego sztucznego serca i głównym architektem jej realizacjinaukawpolsce.pl. Jako wybitny lekarz dowiódł skuteczności takich rozwiązań w praktyce klinicznej, a jako lider i decydent pozyskał zaplecze instytucjonalne, naukowe i finansowe, by polskie sztuczne serce stało się rzeczywistością.
Etapy rozwoju i partnerzy technologiczno-finansowi
Rozwój systemu Religa Heart w Polsce
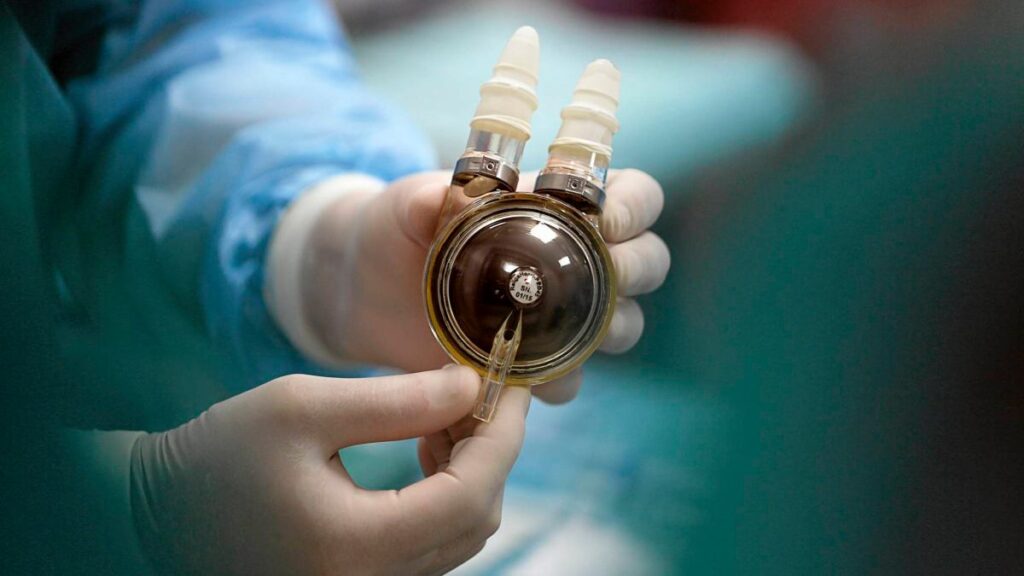
Fundamenty badawcze (lata 90.): Pierwsza faza rozwoju polskiego sztucznego serca koncentrowała się w Fundacji Rozwoju Kardiochirurgii w Zabrzu. W latach 90. powstały prototypy pulsacyjnych protez POLVAD do czasowego wspomagania lewej lub obu komór serca. Projekt ten był możliwy dzięki współpracy lekarzy i inżynierów w ramach FRK oraz wsparciu finansowemu ze źródeł charytatywnych i grantów. Testy laboratoryjne i eksperymenty na zwierzętach umożliwiły wprowadzenie urządzeń do użytku eksperymentalnego – zwieńczeniem tej fazy było opisane wyżej pierwsze wszczepienie polskich komór w 1995 r. przez prof. Religętakdlatransplantacji.pl. Od 1999 r. protezy POLVAD były już stosowane w kilku ośrodkach klinicznych, m.in. w Zabrzu i Aninie, ratując życie setkom pacjentówmedonet.pl.
Program „Polskie Sztuczne Serce” (2007–2012): Kolejny etap rozwoju zainicjował program rządowy o tej nazwie, będący efektem działań prof. Religi jako ministra. Program ten został ustanowiony Uchwałą Rady Ministrów 6 marca 2007 r. w celu opracowania i wdrożenia klinicznego polskich protez sercanaukawpolsce.pl. Koordynatorem projektu została Fundacja Religi w Zabrzu. Program skupił konsorcjum 21 polskich instytutów naukowo-badawczych i 4 czołowych klinik kardiochirurgicznych, integrując wysiłki ekspertów z różnych dziedzinnaukawpolsce.pl. Partnerami technologicznymi były m.in. instytuty biocybernetyki, inżynierii materiałowej, firmy z sektora medycznego oraz zespoły zagraniczne – polscy naukowcy współpracowali z ośrodkami w USA, Europie Zachodniej, Rosji czy Argentynienaukawpolsce.pl. Taka szeroka współpraca zaowocowała nie tylko konstrukcją urządzeń, ale również opracowaniem nowych biomateriałów i technologii (np. specjalnych poliuretanów do komór pomp, zdalnych systemów monitoringu pracy urządzenia)naukawpolsce.pl.
Rodzina prototypów Religa Heart: W ramach programu stworzono całą rodzinę polskich protez serca pod marką ReligaHeartnaukawpolsce.pl. Obejmuje ona następujące urządzenia:
- ReligaHeart EXT – pozaustrojowa, pulsacyjna proteza serca (pompa poza ciałem, połączona z pacjentem za pomocą przewodów). Przeznaczona do krótkoterminowego i średnioterminowego wspomagania krążenia.
- ReligaHeart IMPL – częściowo wszczepialna pulsacyjna pompa wspomagania serca (pompa umieszczona częściowo w ciele pacjenta, z zewnętrznym napędem pneumatycznym).
- ReligaHeart ROT – częściowo wszczepialna pompa wirowa odśrodkowa (rotacyjna III generacji) o ciągłym przepływie, z magnetycznie zawieszonym wirnikiemnaukawpolsce.plnaukawpolsce.pl.
- ReligaHeart AXIAL (nienazwana w cytowanym fragmencie, ale wspomniana) – częściowo wszczepialna pompa wirowa osiowa o ciągłym przepływie (wirnik zawieszony magnetycznie, przepływ zgodny z osią pompy)naukawpolsce.pl.
- ReligaHeart TOTAL – w pełni wszczepialna proteza serca (docelowo total artificial heart), oparta na odśrodkowej pompie wirowej z bezprzewodowym przesyłem energii i sygnałów sterującychnaukawpolsce.pl.
Część z tych urządzeń w trakcie podsumowania programu w 2013 r. była już stosowana u pacjentów (w ramach badań klinicznych), a pozostałe znajdowały się na etapie przedklinicznym, oczekując na testy na ludziachnaukawpolsce.pl. Na przykład prototyp ReligaHeart EXT został dopracowany jako następca POLVAD – zbudowano serię protez klinicznych z nowymi, polskimi zastawkami dyskowymi pokrytymi powłokami węglowymi Moll, cechującymi się wyższą biokompatybilnościąmedonet.plnaukawpolsce.pl. Jednocześnie opracowano pierwszy polski zminiaturyzowany, przenośny sterownik pneumatyczny do pomp serca z zasilaniem bateryjnym, by uniezależnić pacjenta od stacjonarnej konsolimedonet.pl. Umożliwia to większą mobilność chorego i potencjalnie terapię poza szpitalem. ReligaHeart EXT przewidziano do wspomagania przez kilka do kilkunastu miesięcy, a dzięki nowoczesnym biomateriałom wydłużono jej żywotność nawet do 3 lat pracymedonet.pl.
Wsparcie finansowe i partnerzy: Program „Polskie Sztuczne Serce” był finansowany z budżetu państwa jako program strategiczny. Łączny budżet (niecytowany tu bezpośrednio) pozwolił na stworzenie zaawansowanej infrastruktury – w Zabrzu zbudowano np. Laboratorium Technologiczne z czystymi pomieszczeniami do produkcji protez medycznych, gdzie rozpoczęto ograniczoną produkcję serc ReligaHeart EXTnaukawpolsce.pl. Partnerami finansowymi oprócz rządu były m.in. Narodowe Centrum Badań i Rozwoju (NCBiR) i Narodowe Centrum Nauki (NCN) finansujące poszczególne projekty składowe (np. rozwój pomp wirowych). Współpracowały również polskie firmy inżynieryjne i materiałowe, co umożliwiło uniezależnienie się od importu niektórych komponentów (np. własne zastawki zamiast drogich zagranicznych)naukawpolsce.pl.
Postęp kliniczny: Kulminacją tego etapu był pierwszy eksperymentalny zabieg wszczepienia protezy serca ReligaHeart EXT u człowieka w czerwcu 2013 r. (Instytut Kardiologii w Aninie). 50-letni pacjent w skrajnej niewydolności serca został zaopatrzony w najnowszą wersję polskiej protezy pulsacyjnej i pomyślnie doczekał transplantacji sercamedonet.plmedonet.pl. Operację przeprowadził zespół pod kierunkiem dr. Grzegorza Religi, syna Zbigniewa Religimedonet.pl. Był to kamień milowy – polskie sztuczne serce przeszło z fazy badawczej do klinicznej, stając się realną opcją terapeutyczną. Od tamtej pory w kolejnych ośrodkach wszczepiano następne egzemplarze ReligaHeart EXT pacjentom oczekującym na transplantację (dane medialne sugerują pojedyncze do kilkunastu implantacji w pierwszych latach programu). Równolegle trwają prace nad dopuszczeniem do badań klinicznych pomp wirowych ReligaHeart ROT – prototypy tych urządzeń przeszły pomyślne testy in vitro i pilotażowe doświadczenia na zwierzętach do 2015 r.naukawpolsce.plnaukawpolsce.pl, a dalszy rozwój (wersje kliniczne, docelowo w pełni wszczepialne systemy) zależy od pozyskania kolejnego finansowania wdrożeniowegonaukawpolsce.pl.
Rozwój systemu HeartMate w USA
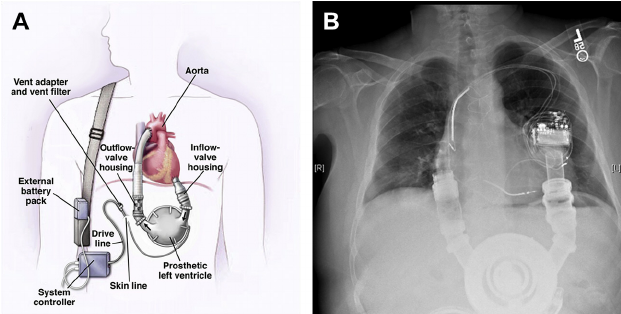
Pierwsza generacja – HeartMate I (pulsacyjne LVAD): Historia systemu HeartMate rozpoczęła się od badań sponsorowanych przez amerykański NIH w latach 80. Firma Thermedics (później Thermo Cardiosystems) opracowała pod kierunkiem dr. Bernharda pierwszą elektronicznie kontrolowaną pompę wspomagania lewej komory, której prototyp wszczepiono z sukcesem w 1988 r.en.wikipedia.org. Wyniki tych badań doprowadziły do współpracy z firmą Thoratec Corporation, która podjęła się dalszego rozwoju i komercjalizacji urządzenia. HeartMate był początkowo pompą pulsacyjną, z wykorzystaniem wypierającej komory poruszanej pneumatycznie lub elektrycznie, naśladującą rytmiczne pompowanie krwi. W 1994 r. FDA zatwierdziła pneumatyczny system HeartMate jako pierwsze trwałe LVAD do zastosowań klinicznych (pomost do transplantacji)en.wikipedia.org. Rok później dopuszczono nowszy model z napędem elektrycznym z wbudowanymi bateriami, co poprawiło mobilność chorychheart.org. Urządzenia te (znane jako HeartMate IP i HeartMate VE/XVE) stanowiły pierwszą generację LVAD. Były one dość duże i masywne – pompa miała objętość kilkuset mililitrów i umieszczana była w jamie brzusznej pacjenta, z dodatkowym przewodem (tzw. vent line) wyprowadzonym przez skórę na zewnątrzmy.clevelandclinic.orgen.wikipedia.org. Zewnętrzny kontroler i akumulatory pacjent nosił przy sobie. Mimo tych niedogodności, HeartMate I okazał się skuteczny w ratowaniu życia: w badaniach klinicznych końca lat 90. (m.in. słynne badanie REMATCH) wykazano, że zastosowanie LVAD znacząco wydłuża przeżycie i poprawia jakość życia u pacjentów w porównaniu z samym leczeniem farmakologicznymmy.clevelandclinic.orgheart.org. Przykładowo, w grupie chorych leczonych tylko zachowawczo przeżycie roczne wynosiło ~25%, a dwuletnie zaledwie 8%, podczas gdy z wszczepionymi HeartMate XVE przeżywalność więcej niż podwoiła się (ok. 52% rocznie)my.clevelandclinic.org. Na fali tych wyników w 2003 r. HeartMate jako pierwszy LVAD uzyskał od FDA rozszerzenie wskazań do tzw. terapii docelowej (destination therapy) – czyli zastosowania u pacjentów, którzy nie kwalifikują się do przeszczepu sercaheart.orgheart.org. Był to punkt zwrotny: odtąd urządzenia tego typu nie służyły już tylko jako czasowe „mosty” do transplantacji, ale stały się alternatywą długoterminowego leczenia niewydolności serca.
Druga generacja – HeartMate II (ciągły przepływ osiowy): Pomimo sukcesów klinicznych, pierwsze pulsacyjne HeartMate miały ograniczoną trwałość – wiele z nich ulegało zużyciu lub powikłaniom w ciągu 1–2 lat pracymy.clevelandclinic.org. Dlatego rozwój skupił się na mniejszych i bardziej niezawodnych pompach ciągłego przepływu. Około roku 2000 Thoratec wprowadził urządzenie HeartMate II – drugiej generacji, oparte na pompie śrubowej (osiowej) z jednym ruchomym elementem – wirnikiem obracającym się wewnątrz obudowymy.clevelandclinic.org. Dzięki uproszczonej konstrukcji udało się radykalnie zmniejszyć rozmiary – HeartMate II waży ok. 350 g i ma długość ok. 7,6 cm, więc mieści się w klatce piersiowej lub górnej części jamy brzusznej, co rozszerzyło wskazania również na kobiety i młodszych pacjentówen.wikipedia.org. Pompa ta wprowadza krew w ciągły ruch (bez pulsów), przez co u pacjentów praktycznie zanika wyczuwalny tętno, co było nowością natury fizjologicznej. HeartMate II po raz pierwszy wszczepiono człowiekowi w 2000 r., a po badaniach klinicznych FDA zatwierdziła go do stosowania jako pomost do przeszczepu w 2008 r., zaś jako terapię docelową w 2010 r. (po wykazaniu przewagi nad XVE). Urządzenie szybko stało się złotym standardem – w latach 2008–2020 wszczepiono je ponad 22 000 pacjentom na świecieheart.org. Wieloletnie obserwacje pokazały, że HeartMate II znacznie poprawia przeżycie długoterminowe: część chorych z tej generacji pomp żyje już ponad 10 lat ze swoim LVADheart.org, co sugeruje, że trwałość urządzenia znacznie przewyższa zakładane początkowo 5 lat. Według ekspertów, HeartMate II zapoczątkował „złotą erę” mechanicznego wspomagania krążenia – dzięki niemu tysiące pacjentów powróciło do aktywnego życia poza szpitalemtermedia.pl.
Trzecia generacja – HeartMate 3 (ciągły przepływ odśrodkowy magnetyczny): Mimo sukcesu HeartMate II, inżynierowie dostrzegli pewne ograniczenia – wirnik oparty był na łożyskach ślizgowych, co generowało tarcie i ciepło, mogące sprzyjać uszkodzeniom krwinek i powstawaniu skrzepówmy.clevelandclinic.org. Dlatego kolejna generacja pomp wykorzystała lewitację magnetyczną wirnika oraz konstrukcję odśrodkową. Firma Thoratec opracowała system HeartMate 3, w którym wirujący dysk nie dotyka żadnej powierzchni, zawieszony w polu magnetycznym. Zapewnia to brak elementów trących, minimalizuje hemolizę i ryzyko wykrzepiania wewnątrz urządzeniamy.clevelandclinic.org. HeartMate 3 charakteryzuje się także kompaktową budową i usprawnionym przepływem krwi przez pompę. Pierwsze implantacje HeartMate 3 u ludzi rozpoczęto w 2014 r. (badania kliniczne w Europie), a FDA zatwierdziła HeartMate 3 w 2017 r. jako pomost do transplantacji, zaś w 2018–2019 również jako terapię docelową po świetnych wynikach badań (m.in. wyraźne zmniejszenie częstości zakrzepicy w pompach w porównaniu z HeartMate II). W Polsce pierwsze dwie pompy HeartMate 3 wszczepiono w 2015 r. w Warszawie (IK Anin) – zabieg ten został odnotowany jako pionierskitermedia.pl. HeartMate 3 zapewnia przepływ do 10 litrów krwi na minutę, a dzięki wydajnym bateriom pacjent może przebywać z dala od stacjonarnego zasilania nawet 17 godzintermedia.pl. Ta generacja jest obecnie uważana za szczytowe osiągnięcie w dziedzinie LVAD, łącząc wysoką trwałość z minimalizacją powikłań.
Partnerzy i zmiany korporacyjne: System HeartMate został oryginalnie rozwinięty przez Thermo Cardiosystems (dział Thermedics) we współpracy z ośrodkami akademickimi (Boston, Houston). W późnych latach 90. Thoratec Corporation – producent innego systemu wspomagania (parakorporowego systemu Thoratec) – połączył siły z Thermo Cardiosystems, stając się głównym dostawcą HeartMate na świecie. W kolejnych latach nastąpiły przejęcia: w 2015 r. firmę Thoratec kupiła St. Jude Medical, a w 2017 r. St. Jude została przejęta przez koncern Abbott Laboratories. Obecnie zatem marka HeartMate jest własnością Abbott, który odpowiada za produkcję i dystrybucję tych urządzeń globalnie. Warto dodać, że obok HeartMate rozwijały się też konkurencyjne systemy LVAD (np. Novacor – pulsacyjny, HeartWare HVAD – odśrodkowy magnetyczny itd.), jednak HeartMate pozostaje jednym z najbardziej rozpowszechnionych i przebadanych klinicznie urządzeń na świecie.
Postęp kliniczny: Na przestrzeni 30 lat system HeartMate uratował życie i poprawił stan zdrowia dziesiątkom tysięcy pacjentów z niewydolnością serca. Urządzenia te były wielokrotnie udoskonalane, zwiększając bezpieczeństwo i komfort pacjentów. Zastosowanie LVAD zmieniło naturalny przebieg choroby – zaawansowana niewydolność serca z rokowaniem gorszym niż wiele nowotworów stała się schorzeniem, które można przewlekle leczyć. Przykładowo, były wiceprezydent USA Dick Cheney żył z HeartMate II przez około 2 lata zanim doczekał się transplantacji serca w 2012 r., zaś słynny baseballista Rod Carew otrzymał HeartMate w 2016 r. i funkcjonuje z nim aktywnie do dziśheart.org. Historie te nagłaśniały skuteczność LVAD w mediach. W badaniach klinicznych odnotowano istotny spadek śmiertelności i poprawę jakości życia dzięki HeartMate (zarówno jako pomost, jak i terapia docelowa)my.clevelandclinic.orgtermedia.pl. Z czasem okazało się również, że u części pacjentów serce wspomagane przez LVAD może odzyskać częściowo funkcję – co pozwala nawet na explantację urządzenia (choć zdarza się to rzadko i głównie u chorych z kardiomiopatią poporodową lub zapalną). Generalnie jednak HeartMate wpisał się na stałe w standardy leczenia niewydolności serca w świecie – jest dostępny w setkach ośrodków, a rocznie wszczepia się kilka tysięcy takich pomp globalnie.
Zastosowania kliniczne i funkcje urządzeń
Religa Heart (Polskie protezy serca): Urządzenia z rodziny ReligaHeart przeznaczone są dla pacjentów z krytyczną, końcową fazą niewydolności serca (NYHA IV), którym grozi zgon z powodu niewydolności krążenia. Głównym wskazaniem jest zastosowanie ich jako pomost do przeszczepu serca – pozwalają pacjentowi przeżyć w relatywnie dobrym stanie do momentu znalezienia odpowiedniego dawcymedonet.pl. Właśnie w takim charakterze użyto protezy ReligaHeart EXT w 2013 r., co umożliwiło skuteczne przetrwanie do transplantacjimedonet.pl. Ponadto, w niektórych sytuacjach protezy te mogą służyć jako pomost do wyzdrowienia – np. u chorych z ostrym zapaleniem mięśnia sercowego lub kardiomiopatią poporodową, wszczepienie sztucznych komór na kilka tygodni odciąża serce i daje mu szansę na regenerację. Prof. Religa opisywał przypadki, gdzie po okresie wspomagania POLVAD-em serce pacjenta odzyskało pełnię funkcji i nie trzeba było wykonywać przeszczeputakdlatransplantacji.pl. ReligaHeart EXT jako pozaustrojowa pompa pneumatyczna, jest przeznaczona do użycia zarówno w warunkach szpitalnych (OIOM, oddział kardiochirurgii), jak i – w ograniczonym zakresie – poza szpitalnych, jeśli pacjent zostanie wypisany z przenośnym systemem zasilaniamedonet.pl. Czas wspomagania zależy od stanu chorego i modelu protezy: pulsacyjne komory EXT przewidziano na kilka miesięcy do roku, choć testy wykazały ich potencjalną trwałość do ~3 latmedonet.pl. Protezy ReligaHeart nie są jeszcze stosowane jako terapia docelowa (zastąpienie serca na stałe) – formalnie w Polsce takie użycie wymagałoby certyfikacji i wskazań, których na razie nie ma. Jednak celem długofalowym zespołu FRK jest stworzenie w pełni wszczepialnego systemu (ReligaHeart TOTAL) zdolnego do permanentnego zastąpienia serca, co mogłoby stanowić krajową alternatywę dla całkowitego sztucznego serca oferowanego za granicąnaukawpolsce.plnaukawpolsce.pl. Podsumowując, obecnie ReligaHeart służy głównie jako pomost do transplantacji lub regeneracji, zapewniając krążenie u najciężej chorych pacjentów, którzy bez takiego wsparcia nie przeżyliby do otrzymania narządu.
HeartMate (system LVAD): Systemy HeartMate (od HeartMate I przez II do 3) znalazły szerokie zastosowanie u pacjentów z zaawansowaną niewydolnością lewokomorową, zarówno tych oczekujących na przeszczep, jak i tych, którzy nie kwalifikują się do transplantacji. W latach 90. HeartMate I (XVE) stosowano głównie jako bridge-to-transplant – pomost do transplantacji serca, umożliwiający chorym doczekanie dawcyheart.org. Jednak wraz z ograniczoną liczbą dawców i pozytywnymi wynikami badań, od 2003 r. urządzenie to uznano także za terapię docelową u pacjentów, dla których transplantacja jest niedostępna (ze względu na wiek, choroby współistniejące itp.)heart.orgtermedia.pl. Tę funkcję przejęły w kolejnej dekadzie ulepszone pompy HeartMate II – wielu pacjentów żyło z nimi przez lata bez zamiaru przeszczepu (tzw. destination therapy). Według danych klinicznych, HeartMate II i III mogą wspomagać serce przez wiele lat (5-10+), co czyni je realną alternatywą dla transplantacji, zwłaszcza u chorych starszych. Wskazania obejmują także pomost do decyzji (bridge to decision) – tymczasowe zastosowanie LVAD u pacjenta w krytycznym stanie, by ustabilizować go i ocenić dalszy plan (transplantacja vs. odłączenie vs. terapia docelowa). Ponadto LVAD bywa stosowany jako pomost do uzyskania kwalifikacji (bridge to candidacy) – np. u pacjenta z początkowo przeciwwskazaną transplantacją, u którego po okresie wspomagania poprawia się funkcja narządów (wątroba, nerki) i staje się on kandydatem do przeszczepu. Wreszcie, rzadziej, LVAD wykorzystuje się jako pomost do rekonwalescencji (bridge to recovery) – jeśli jest szansa, że serce odzyska funkcję (podobnie jak w przypadku ReligaHeart, w szczególnych sytuacjach).
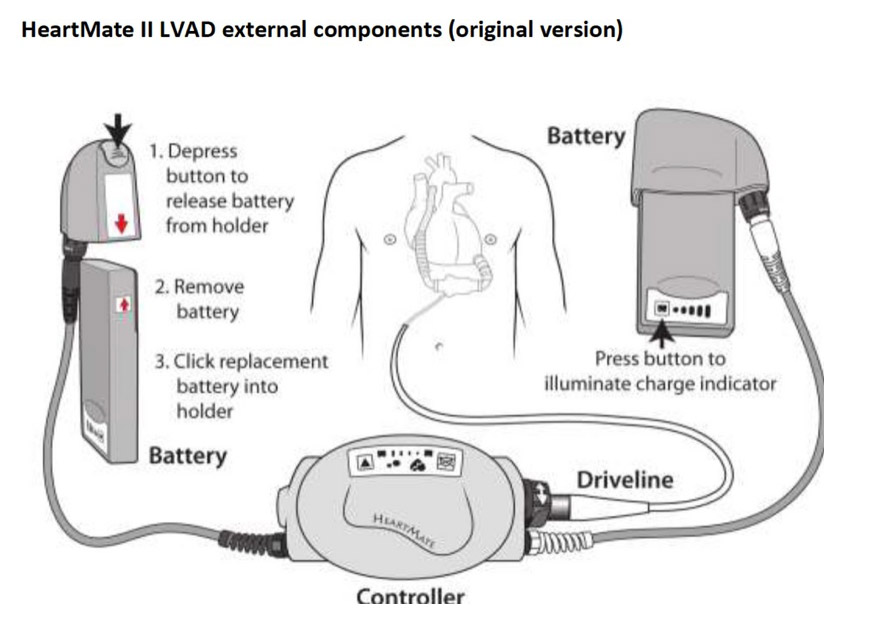
HeartMate II i 3 są urządzeniami wszczepialnymi – pompa umieszczana jest wewnątrz ciała (w koniuszku lewej komory lub okolicy koniuszka) i połączona z aortą, przejmując pracę lewej komorytermedia.pl. Ze względu na swoje kompaktowe rozmiary pacjent może stosunkowo swobodnie funkcjonować z takim urządzeniem poza szpitalem. Z ciała wyprowadzony jest jedynie przewód zasilający (driveline) podłączany do noszonego na zewnątrz kontrolera z bateriami. Pacjenci z HeartMate po wyjściu ze szpitala mogą normalnie chodzić, wykonywać codzienne czynności, a nawet podejmować pracę, oczywiście z pewnymi ograniczeniami (np. unikanie wody, kontrola parametrów)termedia.pl. W ten sposób LVAD z systemu „mostu” przeistoczyły się w formę przewlekłej terapii zastępczej, zapewniając dramatyczną poprawę jakości życia chorych, którzy bez urządzenia byliby przykuci do łóżka tlenowegotermedia.pltermedia.pl.
Reasumując, HeartMate znajduje zastosowanie zarówno jako pomost do przeszczepu, terapia docelowa, jak i w innych strategiach leczenia zaawansowanej niewydolności serca. Jego funkcją jest wspomaganie (lub przejęcie) pracy lewej komory serca, pompując krew do aorty i utrzymując perfuzję organów. Nie jest to totalne sztuczne serce – natywne serce pacjenta zazwyczaj pozostaje na miejscu (w razie powrotu funkcji może znów przejąć pracę). System HeartMate może współpracować również z dodatkowymi urządzeniami – np. rzadko stosuje się dwa LVAD jako BiVAD (lewy i prawy wspomagacz) albo łączy LVAD z sztuczną prawą komorą (np. systemy typu Total Artificial Heart lub kombinacje HeartMate z drugim urządzeniem) u pacjentów z niewydolnością obu komór. Jednak standardowo HeartMate adresuje niewydolność lewokomorową, która dominuje w większości przypadków schyłkowej choroby serca.
Porównanie systemów Religa Heart i HeartMate
System Religa Heart i system HeartMate reprezentują dwa podejścia rozwinięte w różnych warunkach – pierwszy powstał jako narodowy program innowacyjny w Polsce, drugi jako pionierski produkt medyczny w USA. Poniżej przedstawiono zestawienie kluczowych cech obu rozwiązań:
| Kryterium | Religa Heart (Polskie sztuczne serce) | HeartMate (LVAD, USA) |
| Twórcy i ośrodki rozwoju | Fundacja Rozwoju Kardiochirurgii w Zabrzu (inicjator: prof. Z. Religa) we współpracy z ~21 polskimi instytucjami naukowymi i klinikaminaukawpolsce.plnaukawpolsce.pl. Program wspierany przez rząd RP (lata 2007–2012) i krajowe centra badawcze. | Thermo Cardiosystems/Thermedics (USA) finansowane przez NIH (lata 80.), następnie Thoratec Corp. (Kalifornia) – globalny producent urządzeń MCS. Obecnie własność Abbott Laboratories. Rozwój przy wsparciu ośrodków takich jak Texas Heart Institute, Cleveland Clinic itp.en.wikipedia.orgheart.org. |
| Okres powstania | Koncepcja od 1986 r. (Religa)naukawpolsce.pl; pierwsze prototypy (POLVAD) lata 90.; pierwsze wszczepienie polskich komór 1995 r.takdlatransplantacji.pl; program intensywny 2007–2013, zakończony pierwszym wszczepieniem ReligaHeart EXT w 2013 r.dzieje.pl. Obecnie dalsze prace nad wersjami wszczepialnymi trwają. | Pierwsze udane długotrwałe wspomaganie prototypem 1988 r.en.wikipedia.org; zatwierdzenie FDA dla HeartMate I w 1994/95heart.org; rozwój HeartMate II (pierwsze implantacje ~2000, aprobata 2008) i HeartMate 3 (pierwsze implantacje ~2014, aprobata FDA 2017)heart.orgtermedia.pl. |
| Technologia pompy | Pulsacyjne pompy wypierające (I generacja): ReligaHeart EXT – pozaustrojowa komora pneumatyczna, naśladująca pracę serca (objętość wyrzutowa ok. 60–80 ml). Pompy wirowe ciągłe (II/III gen.) w fazie R&D: ReligaHeart ROT (odśrodkowa, maglev) i AXIAL (osiowa) – częściowo wszczepialne, o ciągłym przepływie krwinaukawpolsce.plnaukawpolsce.pl. Docelowo planowana całkowicie wszczepialna pompa odśrodkowa z TET (transmisją energii) – ReligaHeart TOTALnaukawpolsce.pl. | Pulsacyjne LVAD (I gen.): HeartMate I / XVE – elektryczno-pneumatyczna pompa komorowa z biokompatybilną podszewką (pokrycie z fibryny)en.wikipedia.org, napędzana siłownikiem, zapewniająca rzut serca ~5 l/min. Ciągłe LVAD (II gen.): HeartMate II – pompa śrubowa (axial flow) z jednym wirnikiem, ciągły strumień krwi ~3–10 l/mintermedia.pl. Ciągłe LVAD (III gen.): HeartMate 3 – pompa odśrodkowa z magnetycznie lewitującym wirnikiem (pełny maglev), ciągły przepływ, zmienna prędkość (w celu generowania pseudopulsu), wydajność do 10 l/mintermedia.plmy.clevelandclinic.org. |
| Lokalizacja i rozmiar | ReligaHeart EXT: pompa poza ciałem pacjenta – typowo umieszczona przy łóżku lub w mobilnym wózku. Komory połączone z sercem za pomocą kaniul przez skórę. Urządzenie wymaga zewnętrznej konsoli/sterownika pneumatycznego (~kilka-kilkanaście kg). Nowy sterownik polski – przenośny, wielkości walizki/torbymedonet.plnaukawpolsce.pl. Pompy częściowo wszczepialne (IMPL, ROT) – pompę planuje się umieścić w klatce piersiowej lub brzuchu, ale wciąż z wyprowadzeniem przezskórnym (driveline) do zewnętrznego zasilacza. | HeartMate: w pełni implantowalne pompy (oprócz kabla zasilającego). HeartMate I i II były zwykle umieszczane w jamie brzusznej (pierwsze wymagało kieszeni w powłokach brzusznych; HM II – mniejszy, mieszczony preperitonealnie). HeartMate II ma wymiary ok. 3 cale (~7,5 cm) długości i masę 0,5 kgen.wikipedia.org, natomiast HeartMate 3 jest nieco większy (ok. 50% większa średnica od HM II), ale wciąż mieszczący się w śródpiersiu. Każdy system ma przezskórny driveline (przewód) łączący wewnętrzną pompę z kontrolerem i bateriami na zewnątrz. Baterie noszone na pasku lub w kamizelce, pozwalają na kilkanaście godzin pracy bez podłączania do prądutermedia.pl. Ogólnie HeartMate jest bardziej kompaktowy i dyskretny – z zewnątrz widoczny jest tylko cienki przewód i niewielka noszona aparatura, podczas gdy ReligaHeart EXT to system wymagający obecności aparatu na zewnątrz ciała pacjenta. |
| Zastosowanie kliniczne | Pomost do przeszczepu: główne zastosowanie – utrzymanie pacjenta przy życiu do czasu znalezienia dawcy sercamedonet.pl. Pomost do regeneracji: w wybranych przypadkach (np. ciężkie zapalenie mięśnia sercowego) – odciążenie serca na tygodnie/miesiące, potencjalnie prowadzące do odzyskania funkcji przez serce i usunięcia protezytakdlatransplantacji.pl. Terapia docelowa: na razie brak rutynowego zastosowania – polskie protezy nie są jeszcze zatwierdzone do permanentnego zastąpienia serca, choć koncepcja ReligaHeart TOTAL temu służy (przyszły rozwój)naukawpolsce.pl. W praktyce czas wspomagania ReligaHeart zwykle ogranicza się do <1 roku (doczekanie dawcy lub decyzji). | Pomost do przeszczepu: standardowa funkcja – HeartMate pozwala pacjentom oczekiwać na transplantację w domu lub szpitalu przez wiele miesięcytermedia.pl. Terapia docelowa: od 2003 r. oficjalnie stosowany u chorych, którzy nie mogą mieć przeszczepu (np. zbyt wysoki wiek, przeciwwskazania)termedia.pl – LVAD pozostaje wówczas dożywotnio. Pomost do decyzji/kwalifikacji: krótkoterminowe wsparcie u pacjentów w krytycznym stanie, aby poprawić ich stan i ocenić dalsze leczenie. Pomost do wyzdrowienia: rzadko, ale bywa odłączany, gdy serce samoistnie się poprawi. Generalnie HeartMate jest elastyczny w zastosowaniu – może służyć zarówno jako rozwiązanie tymczasowe, jak i wieloletnie, zależnie od strategii leczenia i stanu pacjenta. |
| Skuteczność i wyniki | W badaniach polskich protezy wykazały skuteczność w podtrzymaniu życia pacjentów do transplantacji – np. pierwsza implantacja ReligaHeart EXT zakończyła się udanym przeszczepem po kilkunastu dniach, a pacjent był w dobrym stanie w okresie wsparciamedonet.pl. Łącznie protezy POLVAD/ReligaHeart pomogły setkom pacjentów w Polsce doczekać nowego serca lub poprawy stanu (ponad 280 zastosowań do 2013 r.)medonet.pl. Odsetki przeżyć z ReligaHeart nie były publikowane tak szeroko jak w przypadku urządzeń amerykańskich (z racji mniejszej skali zastosowań i fazy badań). Wiadomo jednak, że najdłuższy czas wspomagania polską protezą wyniósł ponad 1,5 roku ciągłej pracymedonet.pl, co świadczy o dużej niezawodności konstrukcji. | Skuteczność HeartMate jest udokumentowana w licznych badaniach: w badaniu REMATCH zastosowanie LVAD obniżyło roczną śmiertelność u pacjentów z 75% do ~48%, a dwuletnią z 92% do ~76%, podwajając szanse przeżycia w porównaniu z terapią farmakologicznąmy.clevelandclinic.org. Nowsze generacje jeszcze poprawiły wyniki – w badaniach HeartMate II i III wykazano ponad 80% przeżycia rocznego i istotną poprawę jakości życia (większość pacjentów w NYHA I–II po implancie). Ponadto HeartMate 3 zredukował częstość poważnych powikłań (zakrzepów pomp, udarów) w porównaniu do poprzednika. Do 2018 r. wszczepiono ponad 22 000 urządzeń HeartMate II na świecieheart.org, z czego wiele pracowało >5 lat bez awarii, a niektóre >10 lat (przewidywana trwałość HM3 przekracza 10 lat). System HeartMate udowodnił więc wysoką skuteczność w wydłużaniu życia i poprawie jego jakości u pacjentów, którzy wcześniej nie mieli opcji terapeutycznych. |
| Dostępność i status | Protezy ReligaHeart są na etapie wczesnej komercjalizacji. Zakończono fazę badawczo-rozwojową z sukcesem (urządzenia gotowe do produkcji seryjnej)naukawpolsce.pl, lecz pełna komercjalizacja wymaga dalszych inwestycji i procedur rejestracyjnych (np. certyfikacji CE). Na razie stosowane są w ramach ograniczonych badań klinicznych w Polsce (Zabrze, Warszawa, być może inne ośrodki). Fundacja Religi deklaruje chęć wprowadzenia tych protez na rynek globalny i uczynienia z nich polskiego produktu eksportowegonaukawpolsce.pl. Warunkiem jest jednak zdobycie funduszy na produkcję i przebicie się przez konkurencję dużych firm zachodnichnaukawpolsce.pl. W kraju system jest dostępny tylko w wybranych klinikach i nie stanowi jeszcze standardowego wyposażenia – raczej opcję w ramach programów naukowych. | HeartMate jest powszechnie dostępny w krajach rozwiniętych. Urządzenia te mają certyfikaty FDA (USA) oraz CE (Europa) dla wskazań BTT i DT, co oznacza, że mogą być używane rutynowo w praktyce klinicznej. W Polsce systemy HeartMate (głównie HeartMate II i 3) są dostępne w ośrodkach kardiochirurgii transplantacyjnej (Warszawa, Zabrze, Kraków, Wrocław i in.) i bywały wszczepiane w programach klinicznych finansowanych przez NFZ. Na świecie HeartMate należy do standardu opieki zaawansowanej niewydolności serca – tysiące pacjentów żyje z tymi pompami, a kolejne implantacje odbywają się każdego tygodnia. Producent (Abbott) zapewnia szkolenia, serwis i wsparcie ośrodkom wszczepiającym. W praktyce dostępność ogranicza jedynie koszt i infrastruktura – wymagany jest doświadczony zespół oraz zaplecze (co większość wysokospecjalistycznych klinik posiada). |
| Koszt urządzenia | Polskie sztuczne serca cechują się niższym kosztem produkcji w porównaniu do zagranicznych odpowiedników. Szacunkowy koszt wytworzenia protezy ReligaHeart EXT to rzędu kilku do kilkunastu tysięcy euronaukawpolsce.pl. Dzięki krajowej produkcji uniknięto drogich licencji (np. własne zastawki zamiast importowanych). Według danych Fundacji, amerykańskie systemy sztucznego serca są wielokrotnie droższe – cena pojedynczego urządzenia przekracza 70 tys. euronaukawpolsce.pl. Potencjalnie więc polski produkt mógłby być tańszą alternatywą dla służby zdrowia. Należy jednak pamiętać, że ReligaHeart nie jest jeszcze produktem komercyjnym – wymagałby nakładów na certyfikację i masową produkcję. | System HeartMate jest bardzo zaawansowany technologicznie, co przekłada się na wysoki koszt. Pełny zestaw HeartMate III (pompa, sterownik, baterie) kosztuje w granicach 100–200 tys. USD (w zależności od rynku i negocjacji; cena katalogowa była podawana powyżej 100 tys. €)naukawpolsce.pl. Sam koszt produkcji jest niższy, ale dochodzą wydatki na R&D, serwis, zysk producenta. Dla szpitali zakup LVAD to poważna inwestycja, jednak w krajach rozwiniętych często refundowana. W Polsce wszczepienia LVAD są finansowane w ramach specjalnych programów (koszt terapii jest porównywalny z transplantacją serca). Ogólnie HeartMate to rozwiązanie drogie, co ogranicza dostęp w biedniejszych systemach ochrony zdrowia – stąd duże zainteresowanie tańszą alternatywą, jaką może być ReligaHeart w przyszłościnaukawpolsce.pl. |
Bibliografia (wybrane źródła):
- Fundacja Rozwoju Kardiochirurgii: komunikat PAP „Polskie Sztuczne Serce – sojusz medycyny, nauki i techniki” (16.12.2013) – podsumowanie programu ReligaHeart : naukawpolsce.plnaukawpolsce.pl.
- Medonet/PAP: artykuł „Wszczepiono polską protezę serca Religa Heart” (2013) – opis pierwszej implantacji ReligaHeart EXT : medonet.plmedonet.pl.
- Dzieje.pl: biografia „Zbigniew Religa – 10 lat od śmierci” – informacje historyczne o pierwszych przeszczepach i sztucznym sercu w 1991 r.: dzieje.pl.
- Wywiad „Religa – człowiek z sercem w dłoni” (takdlatransplantacji.pl) – wspomnienia prof. Religi nt. pierwszych polskich protez (1995) i programu rządowego: takdlatransplantacji.pltakdlatransplantacji.pl.
- Cleveland Clinic Podcast „Evolution of LVADs” (2020) – historia rozwoju HeartMate I/II/III, wyniki badań REMATCH, dane o przeżywalności: my.clevelandclinic.orgmy.clevelandclinic.org.
- American Heart Association News „Past, present and future of the LVAD” (2018) – artykuł przeglądowy o HeartMate (generacje, 22 000 implantacji HeartMate II): heart.orgheart.org.
- Informacja prasowa IK Warszawa „Pierwszy w Polsce HeartMate III” (Menedżer Zdrowia, 2015) – zastosowanie HeartMate III jako pomostu i terapii docelowej: termedia.pltermedia.pl.
